Publié le 10.12.2025
Présentation
Les fonctions cognitives reposent sur l’établissement précis des circuits neuronaux dès les stades précoces du développement embryonnaire. Les études réalisées au cours des 10 dernières années ont révélé que les altérations du développement du cerveau peuvent contribuer à de nombreuses maladies neurodéveloppementales et mentales telles que le déficit intellectuel et l’autisme, l’épilepsie, la schizophrénie, les troubles bipolaires ou obsessionnels et compulsifs.
Nos travaux ont montré que le développement correct du cortex cérébral requiert un type de neurones particuliers qui migrent, coordonnent la construction des circuits neuronaux et disparaissent à la fin du développement. Nous avons également montré que des modifications de leur vitesse de migration ou des altérations de leur mort cellulaire à la fin de la corticogénèse ont de profondes répercussions sur l’établissement des circuits neuronaux. Ces cellules transitoires signalisatrices expriment fortement des gènes dont des mutations sont associées à des maladies neurologiques ou psychiatriques. Lors des premières étapes de la corticogénèse chez la souris, bien avant que les synapses fonctionnelles ne soient formées, ces neurones expriment des protéines impliquées dans la neurotransmission et sensées être exclusivement présentes à la synapse mature. Nos résultats récents montrent que certaines de ces protéines synaptiques impliquées dans des pathologies contrôlent également la migration neuronale au cours de l’embryogenèse. Par ailleurs, l’augmentation du nombre et de la diversité de ces neurones transitoires signalisateurs chez les primates suggère un rôle au cours de l’évolution dans la complexification des connexions au sein du cortex cérébral et des fonctions cognitives.
En étudiant le développement des neurones transitoires chez le rongeur et les primates dans des conditions physiologiques ou altérées, nos projets futurs ont pour objectif de relier le développement du cerveau avec l’évolution et la pathologie chez l’homme. En particulier, nous étudions sur le plan moléculaire le rôle des neurones transitoires signalisateurs comme organisateurs au cours du développement du neocortex. Nous déterminons également comment l’acquisition de ces neurones chez les mammifères a contribué à l’évolution du néocortex et enfin comment des modifications de leur vitesse de migration, de leur nombre ou de leur survie affectent les circuits neuronaux conduisant à des états pathologiques. Nous utilisons une approche multidisciplinaire incluant la génétique de la souris (traçage et ablation cellulaire, inactivation génique), des modifications pharmacologiques et génétiques (électroporation in utero) au cours de l’embryogenèse pour étudier in vitro et in vivo le profil transcriptomique, la migration de cellules uniques par vidéo-microscopie et le comportement des animaux génétiquement modifiés. De plus, grâce à des collaborations, nous étudions la neurotransmission grâce à des techniques d’électrophysiologie et d’optogénetique et nous établissons des modèles mathématiques de distribution cellulaire.
Nos projets couvrent de nombreux aspects de la pathologie depuis les malformations corticales précoces du cerveau jusqu’à la susceptibilité aux maladies psychiatriques caractérisées par des manifestations cliniques plus tardives. Nous avons rejoint l’institut Imagine (Institut des Maladies Génétiques, Hôpital Necker Enfants malades, Paris) et également l’Institut de Psychiatrie et Neurosciences de Paris (IPNP, Hôpital Saint Anne, Paris) où nous allons développer ce projet translationnel en collaboration étroite avec des neuroscientifiques, des généticiens et des cliniciens experts dans les maladies rares, l’imagerie cérébrale et les malformations du cerveau.
Equipe
Ressources & publications
-
 2025Journal (source)Development
2025Journal (source)DevelopmentDifferential contribution of P73+ Cajal-Retzius cells and Reelin to cortical ...
-
 2024Journal (source)J Clin Invest
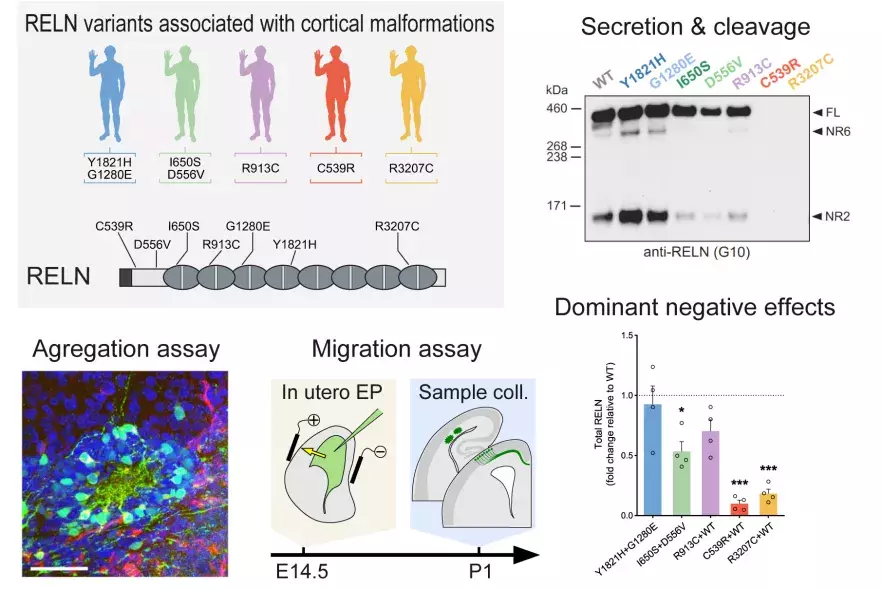
2024Journal (source)J Clin InvestDe novo monoallelic Reelin missense variants act in a dominant-negative manne...
-
 2023Journal (source)Dev Cell
2023Journal (source)Dev CellRepurposing of the multiciliation gene regulatory network in fate specificati...
-
 2023Journal (source)J Comp Neurol
2023Journal (source)J Comp NeurolDiversity within olfactory sensory derivatives revealed by the contribution o...
-
 2023Journal (source)Cell
2023Journal (source)CellTransient perinatal metabolic shifts determine neuronal survival and functio...
-
 2023Journal (source)Nat Commun
2023Journal (source)Nat CommunAberrant survival of hippocampal Cajal-Retzius cells leads to memory deficits...
-
 2023Journal (source)Int J Mol Sci
2023Journal (source)Int J Mol SciActivation of the PI3K/AKT/mTOR Pathway in Cajal-Retzius Cells Leads to Their...
-
 2023Journal (source)Curr Opin Neurobiol
2023Journal (source)Curr Opin NeurobiolCajal-retzius cells: Recent advances in identity and function
-
 2021Journal (source)Development
2021Journal (source)DevelopmentSingle-cell transcriptomics of the early developing mouse cerebral cortex dis...
-
 2021Journal (source)Development
2021Journal (source)DevelopmentThe multiple facets of Cajal-Retzius neurons.
-
 2021Journal (source)Semin Cell Dev Biol
2021Journal (source)Semin Cell Dev BiolWiring of higher-order cortical areas: Spatiotemporal development of cortical...
-
 2020Journal (source)Cell Rep
2020Journal (source)Cell RepEvolutionary Gain of Dbx1 Expression Drives Subplate Identity in the Cerebral...
-
 2020Journal (source)Nat Commun
2020Journal (source)Nat CommunDevelopmental cell death regulates lineage-related interneuron-oligodendrogli...
-
 2020Journal (source)Front Cell Dev Biol
2020Journal (source)Front Cell Dev BiolHow Do Electric Fields Coordinate Neuronal Migration and Maturation in the De...
-
 2019Journal (source)Neurol Genet
2019Journal (source)Neurol GenetDelineating FOXG1 syndrome: From congenital microcephaly to hyperkinetic ence...
-
 2019Journal (source)Cereb. Cortex
2019Journal (source)Cereb. CortexExtracellular Pax6 Regulates Tangential Cajal-Retzius Cell Migration in the D...
-
 2019Journal (source)Eur J Med Genet
2019Journal (source)Eur J Med GenetFurther refinement of COL4A1 and COL4A2 related cortical malformations.
-
 2018Journal (source)Curr. Opin. Neurobiol.
2018Journal (source)Curr. Opin. Neurobiol.Cortical developmental death: selected to survive or fated to die.
-
 2018Journal (source)Cereb. Cortex
2018Journal (source)Cereb. CortexEnhanced Abventricular Proliferation Compensates Cell Death in the Embryonic ...
-
 2017Journal (source)Cell Rep
2017Journal (source)Cell RepTargeted Inactivation of Bax Reveals a Subtype-Specific Mechanism of Cajal-Re...

Chiifres clé
22 membres
7 nationalités
2 laboratoires associés