Publié le 30.07.2025
La drépanocytose est une maladie génétique due à une mutation du gène de la globine β, qui s’associe normalement par groupe de 4 molécules pour former l’hémoglobine. La forme mutée de la globine (appelée globine βS) mène à la production d’hémoglobine drépanocytaire toxique (dite HbS). La forme anormale adoptée par cette protéine déforme les globules rouges, qu’on dit alors « en faucille », ce qui entraine des anémies, des occlusions douloureuses des vaisseaux sanguins et un risque accru d’infections.
Les approches de thérapie génique représentent une solution thérapeutique pour ces patients. Elles reposent sur la transplantation de cellules souches et progéniteurs hématopoïétiques (responsables de la production de toutes les cellules du sang, dont les globules rouges), génétiquement modifiées. En effet, un type spécifique de globine, dite fœtale (HbF), synthétisée seulement dans les globules rouges du fœtus et qui disparait progressivement après la naissance, peut être « réactivée » pour assurer un rôle de globine thérapeutique en remplaçant l’hémoglobine drépanocytaire, ce qui permet de limiter la déformation en faucille des globules rouges. Néanmoins, un certain nombre de difficultés ou complications sont à anticiper, comme la faible expression de la globine thérapeutique et le faible taux de greffe, voire les risques de mutations et de prolifération anormale des cellules hématopoïétiques une fois celles-ci modifiées.
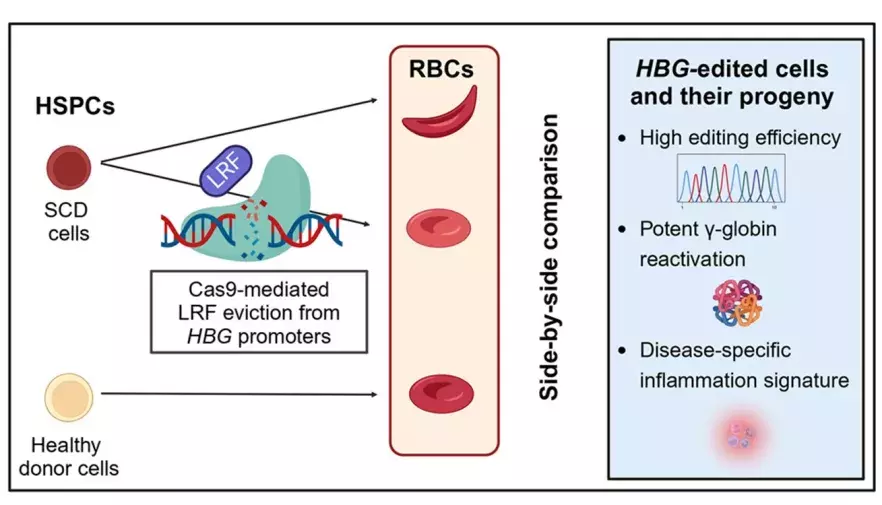
Pour ces raisons, le profil de sécurité des approches de thérapie génique doit être soigneusement évalué. Dans ses récents travaux publiés dans la revue scientifique Molecular Therapy, Giacomo Frati et Mégane Brusson, du laboratoire « Chromatine et régulation génique au cours du développement » dirigé par Annarita Miccio, ont analysé les effets de l’édition génétique médiée par CRISPR-Cas9, les fameux « ciseaux moléculaires », afin d'évaluer l'efficacité et la sécurité d'une approche de thérapie génique dans des conditions cliniquement pertinentes.
Les chercheurs ont modifié le génome des cellules souches hématopoïétiques issues de donneurs sains et de patients drépanocytaires, pour pouvoir les comparer dans des conditions identiques. La stratégie d'édition du génome ici évaluée a pour objectif d’empêcher la régulation négative du gène de l’HbF par le facteur LRF, connu pour réprimer l’expression de l’HbF. Pour ce faire, les chercheurs ont modifié l’ADN des cellules souches pour supprimer les sites de liaison de ce facteur aux séquences ADN régulant l’expression de l’HbF. L’efficacité du protocole a pu être évaluée chez les donneurs sains et les patients : dans les deux cas, une synthèse importante de l'HbF dans les globules rouges issus des cellules modifiées a bien été observée. L’édition génétique s’avère plus efficace dans les cellules drépanocytaires que dans les cellules saines, mais chez les deux elle n'a pas entravé la différenciation des HSPC en globules rouges et cellules sanguines, ni la greffe des cellules après injection chez les souris (bien qu’elle soit sensiblement moins efficace avec les cellules drépanocytaires).
Cependant, l’équipe a détecté une activité hors cible et des réarrangements chromosomiques, en particulier dans les échantillons de cellules drépanocytaires (probablement en raison de l'efficacité globale plus élevée de l'édition), mais sans que cela n’impacte l'expression du gène cible. Les analyses transcriptomiques ont également montré que la procédure d'édition entraîne une régulation à la hausse des gènes impliqués dans les réponses inflammatoires et face aux dommages à l'ADN, et ce de manière plus marquée dans les HSPC drépanocytaires.
Bien que cette étude apporte la preuve de l'efficacité et de l'innocuité d'une stratégie d'édition basée sur la réactivation de l'HbF, elle souligne surtout la nécessité de réaliser d’évaluer la sécurité des conditions cliniques pertinentes : il est crucial pour tout nouveau traitement d’assurer et d’évaluer sa sécurité et sa non-toxicité, en parallèle de, voire avant, son efficacité.
Référence : Safety and efficacy studies of CRISPR-Cas9 treatment of sickle cell disease highlights disease-specific responses
Frati et al., Molecular Therapy, 2024
DOI: 10.1016/j.ymthe.2024.07.015